Accueil » Qualité de l’air » Couche d’ozone
L’ozone est un gaz bleuté à haute concentration, odorant et très irritant, composés de trois atomes d’oxygène (O).
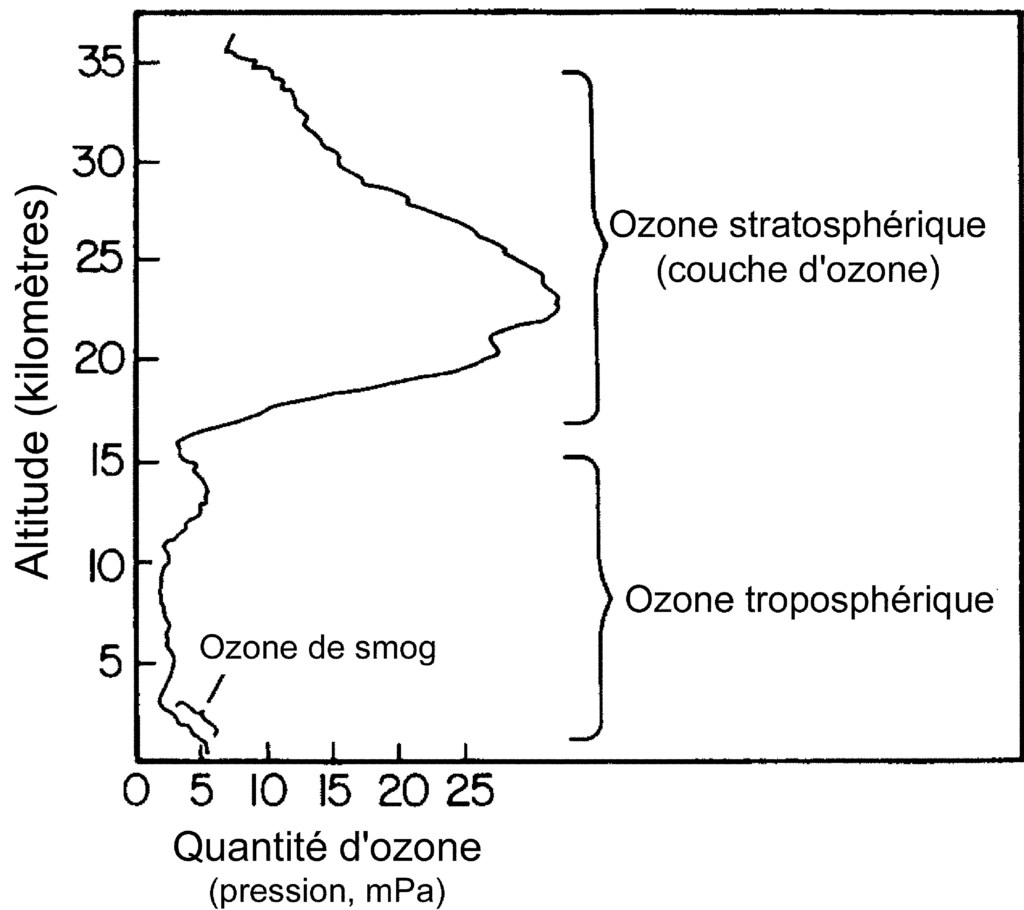
Il est présent dans toute l’atmosphère, mais c’est dans la stratosphère que se trouve la plus grande partie (environ 90 % de tout l’ozone). L’ozone se retrouve aussi en faible quantité au niveau troposphère. Néanmoins il n’y joue pas les mêmes rôles ; de bénéfique en « altitude », il devient nocif au « sol ».
L’ozone se forme par action de la lumière sur l’oxygène : une molécule d’O2 est séparée en 2 atomes d’oxygène ; ceux-ci se rejoignent à nouveau ou rejoignent chacun une molécule d’O2 pour former de l’O3, l’ozone. Ces réactions ont surtout lieu au-dessus des tropiques. L’ozone gagne ensuite les pôles via la circulation des masses d’air.
L’ozone peut aussi être détruit suite à l’action de la lumière sur la molécule ou suite à l’interaction avec des molécules contenant des atomes d’hydrogène, de chlore et/ou de brome. Si une partie de ces molécules est d’origine naturelle, beaucoup proviennent de composés de synthèse et donc créés par l’homme.
C’est, à quelque 25 km d’altitude, que se trouve la plus grande partie de l’ozone. Cette strate d’air riche en ozone s’appelle la » couche d’ozone » (voir la figure ci-dessus). La quantité d’ozone qui se trouve au-dessus d’un point donné varie naturellement avec la latitude et la saison, mais aussi d’un jour à l’autre, au gré des conditions météorologiques.
L’ozone stratosphérique absorbe les rayons solaires nocifs (les UV) – toutes les formes de vie sur la Terre se sont adaptées à ce filtre des rayons solaires. Or, l’exposition à ces rayons UV comporte des risques significatifs pour la santé (cancer de la peau, cataracte, système immunitaire) et pour la biodiversité (en affectant par exemple le plancton à la base de la chaîne alimentaire marine).
Il y a aussi de l’ozone, mais en très faibles quantités dans la troposphère. Cet ozone troposphérique provient d’une réaction des rayons solaires sur des composés organiques volatils (COV) et des oxydes d’azote (NOx), dont certains sont produits par l’activité humaine. L’ozone troposphérique est une composante du « smog photochimique ».
L’ozone troposphérique est un polluant. Il affecte la santé humaine en altérant les fonctions cellulaires au niveau des muqueuses (oculaires et pulmonaires en particulier). Par ailleurs, pic d’ozone et vague de chaleur sont souvent conjugués entraînant une surmortalité. Pour plus d’informations sur cette pollution photochimique, cliquez ici.
Il y a appauvrissement de l’ozone quand l’équilibre naturel entre la production et la destruction d’ozone stratosphérique est rompu et que la destruction est plus rapide que la production. Ce qu’on appelle communément le » trou de la couche d’ozone » est en fait une diminution rapide et étendue de l’abondance des molécules d’ozone et non pas une absence complète de molécules.
L’unité de mesure utilisée est le Dobson. Une unité correspond au nombre de molécules d’ozone qui serait nécessaire pour créer une pure couche d’ozone de 0,01 mm à une température de 0°C et 1 pression d’une atmosphère. La moyenne d’ozone dans l’atmosphère est de 300 unités Dobson (soit l’équivalent d’une couche de 3 mm). En dessous de 220 unités Dobson, on parle de « trou dans la couche d’ozone » car de telles valeurs n’ont jamais été observées avant 1979.
Ce sont des composés de synthèse produits par l’homme et contenant du chlore et du brome qui sont responsables du trou dans la couche d’ozone. Il s’agit des Substances Appauvrissant la couche d’Ozone (SAO, ou ODS en anglais pour « Ozone Depleting Substance ») comme les CFCs que l’on retrouvait entre autres dans les aérosols.
Ces substances sont redoutables pour deux raisons. Tout d’abord, elles sont stables dans les couches inférieures de l’atmosphère ce qui leur permet in fine de passer dans la stratosphère. Ensuite, une fois dans l’atmosphère, ces molécules, sous l’effet des rayons UV de type C, libèrent des atomes de chlore ou de brome qui, à leur tour, entrent dans des réactions chimiques qui décomposent d’une part l’ozone mais surtout laissent intacts les atomes de chlore et de brome leur permettant de continuer à détruire des molécules d’ozone. Ainsi, un seul atome de chlore peut détruire jusqu’à 100.000 molécules d’ozone avant de former un composé stable et disparaître.
Pour tenter de remédier à ce problème. Le protocole de Montréal a été adopté en 1989. D’après le Secrétariat ozone, grâce à son action, 98% des niveaux historiques de production et de consommation des SAO ont été éliminés. Dès lors, si la mise en œuvre du Protocole continue, la couche d’ozone devrait retrouver ses niveaux d’avant 1980 d’ici la moitié du siècle. Pour la zone de l’antarctique, il faudra attendre 15 ans de plus.
Parallèlement, on assiste à un appauvrissement général dans le monde entier depuis les années 1980. En 2011, la destruction de la couche d’ozone a atteint un niveau record au niveau de l’Arctique où une déperdition de 40% a été enregistrée entre le début de l’hiver et la fin du mois de mars.
L’apparition du trou dans la couche d’ozone au dessus de l’antarctique à des moments précis est due à un phénomène particulier qui se développe dans les régions polaires. En fait, les atomes de chlore issus des CFCs réagissent avec d’autres substances pour former des molécules stables comme l’acide chlorhydrique, constituant ainsi un réservoir inoffensif de chlore. Cependant, durant l’hiver et spécifiquement en antarctique, des conditions atmosphériques particulières se développent : un vortex polaire (vents tourbillonnants) et des températures très froides permettent l’apparition de nuages où se produisent alors d’autres réactions chimiques transformant l’acide chlorhydrique en dichlore (Cl2). Sous l’action du soleil (avec l’arrivée du printemps), cette molécule se sépare en deux atomes qui détruisent les molécules d’ozone tout en laissant les atomes de chlore intacts à la fin de la réaction.
Les conditions climatiques étant très stables en antarctique et l’hiver y étant toujours très froid, c’est un phénomène qui a lieu annuellement.
Dans l’arctique, où les conditions climatiques sont plus variables et les températures plus chaudes, la destruction de l’ozone est très variable d’une année à l’autre. En 2011, les températures dans la stratosphère étaient plus froides que la normal et le vortex polaire s’est également maintenu plus longtemps provoquant ainsi une destruction importante et record de l’ozone dans cette région.
Le site de la NASA dédié à la problématique fournit une évaluation régulière de la situation.
Toutes les substances n’ont pas le même impact sur la couche d’ozone. C’est pourquoi chaque composé est mesuré par une « potentiel d’appauvrissement de la couche d’ozone » (PAO ou en anglais ODP pour « Ozone Depleting Potential »), qui est estimé de façon relative, par rapport à un composé de référence, qui est le CFC11 (le potentiel de réduction de ce composé étant fixé à 1). Ci-dessous ; voici un rapide aperçu des principaux composés :
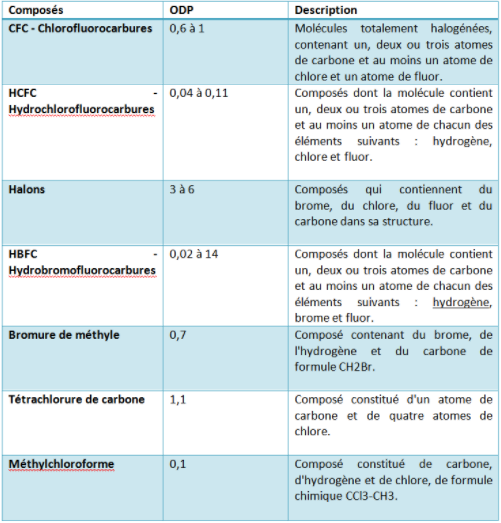
Ces substances sont utilisées dans une large gamme de produits & équipements comme la réfrigération, le conditionnement d’air, les pompes à chaleur, les mousses d’isolation, certains dispositifs d’extinction, les aérosols, les dispositifs de fumigation… Ci-dessous, voici une brève description pour trois substances communes :
CFC : Chlorofluorocarbures. Ces composés ont été développés dans les années trente. Ses propriétés sont très intéressantes : stable, ininflammable, non toxique, facile à conserver et faible coût de production. A l’origine, ils étaient utilisés comme fluide réfrigérant, mais à partir de 1950, on les retrouve également comme agent propulseur dans les aérosols et comme solvants dans l’industrie électronique fine, dans la production de mousses rigides et souples, etc.
Halons : Les halons sont utilisés comme extincteurs d’incendie aussi bien dans des dispositifs fixes que dans des extincteurs portatifs. Etant donné que les halons contiennent du brome, ils ont un pouvoir de destruction de la couche d’ozone très élevé. Dans les pays de l’Union européenne leur installation est interdite depuis de nombreuses années. Les systèmes existants contenant ces gaz ont même dû être démantelés (avec récupération du gaz). Une exception toutefois, à savoir que leur utilisation reste autorisée dans les « utilisations critiques de halons ». Il s’agit d’applications très spécifiques pour lesquelles, faute de substituts suffisamment performants, l’utilisation de ces gaz reste encore autorisée, mais est très encadrée. C’est par exemple le cas pour la protection incendie de centrales nucléaires ou les extincteurs portables présents dans les avions.
HCFC : Hydrochlorofluorocarbures. Les HCFC ont un pouvoir de destruction de la couche d’ozone inférieur à celui des CFC. L’hydrogène les rend moins stables et, par conséquent, moins dommageables pour la couche d’ozone que les CFC. Les HCFC sont encore largement utilisés en remplacement des CFC dans de nombreux pays. Ils sont utilisés comme agent réfrigérant, pour la fabrication de mousses synthétiques, comme agent propulseur dans certains aérosols. Comme ils possèdent tout de même un potentiel d’appauvrissement de l’ozone, ils ne constituent qu’une solution temporaire. Pour de nombreuses applications des alternatives sont maintenant disponibles. C’est généralement dans les pays de l’Union européenne que ces alternatives sont le plus largement utilisées en raison d’une réglementation européenne ambitieuse de réduction de mise sur le marché et d’utilisation de ces substances. Il convient toutefois de remarquer que dans plusieurs applications, même si ce n’est pas systématique, les HCFC sont souvent remplacés par des substances de type HFC, qui ne présentent plus aucun potentiel d’appauvrissement de la couche d’ozone mais qui sont des gaz à effet de serre puissants.

L’appauvrissement de la couche d’ozone et le changement climatique ont généralement été considérés comme deux problèmes environnementaux distincts. Toutefois, il existe des interactions importantes entre les phénomènes physiques se produisant au sein des différentes couches de l’atmosphère, si bien qu’un déséquilibre observé dans un compartiment de l’atmosphère va induire des déséquilibres dans d’autres compartiments. En effet, si les gaz à effet de serre réchauffent la température en surface, ils refroidissent les hautes couches de l’atmosphère. Or, le froid favorise la destruction de l’ozone stratosphérique. Les variations du climat pourraient donc retarder la régénération de la couche d’ozone, qui nous protège des rayons ultraviolets du Soleil. Des recherches sont actuellement conduites afin de mieux comprendre ces interactions.
Par ailleurs, l’ensemble des composés incriminés dans la destruction de la couche d’ozone sont également des gaz à effet de serre puissants. Cette méconnaissance est principalement liée à la chronologie d’adoption des Protocoles de Montréal et de Kyoto. Vu que le Protocole de Kyoto, relatif aux gaz à effet de serre, a été adopté ultérieurement au Protocole de Montréal qui traite des composés détruisant la couche d’ozone, il a été décidé que les composés visés par le Protocole de Montréal ne feraient pas partie de la liste des composés sous le Protocole de Kyoto. Ces composés n’entrent donc pas en compte dans les inventaires et les objectifs de réduction des émissions de gaz à effet de serre, lesquels découlent du Protocole de Kyoto.
A l’inverse, le N2O ou protoxyde d’azote est un gaz à effet de serre repris sous le Protocole de Kyoto. Aujourd’hui, il est le troisième gaz à effet de serre et la première substance appauvrissant la couche d’ozone du fait des efforts accomplis pour éliminer la production de composés comme les CFC . En effet, le N2O est un gaz très stable. Il s’accumule donc dans l’atmosphère pour finir par atteinte la stratosphère. Là, il réagit avec des atomes d’oxygène pour former de l’oxyde nitrique (NO) qui réagit avec des molécules d’Ozone (O3), détruisant ainsi ces dernières.
Enfin, l’action en faveur d’un des Protocoles peut aussi avoir des impacts sur l’autre. C’est le cas pour certaines substances appauvrissant la couche d’ozone qui ont été remplacées par des HFC, un gaz à effet de serre sous le Protocole de Kyoto. Or ci ce dernier n’appauvrit pas la couche d’ozone, il a un potentiel de réchauffement global très élevé. S’il équivaut aujourd’hui à 2 % des GES émis, il pourrait atteindre 20 à 50% en 2050.
C’est dès lors en adoptant une approché intégrée luttant contre l’appauvrissement de la couche d’ozone et les changements climatiques que nous auront de meilleures chances de préserver notre planète.
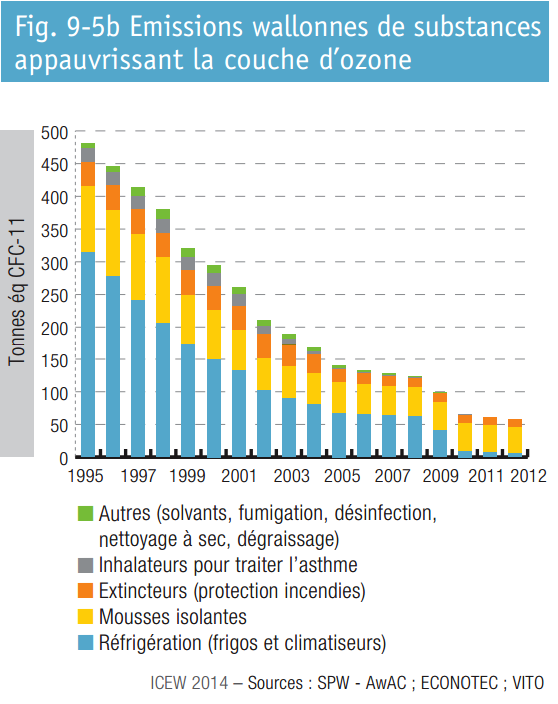
Le graphique suivant illustre les émissions wallonnes de substances appauvrissant la couche d’ozone. On y observe une baisse importante des émissions.
Mousses d’isolation thermique
Ces émissions, encore actuellement les plus importantes, proviennent majoritairement des mousses d’isolation contenant des CFC (mousses de polyuréthane et de polystyrène extrudé). Bien que leur commercialisation soit interdite depuis le 31 décembre 1994 (Directive CE 3093/94), la plus grande partie du gaz utilisé pour en effectuer leur moussage est encore contenue au sein des mousses installées depuis de nombreuses années. Le gaz reste en effet emprisonné au sein de la structure de la mousse lors de sa fabrication pour n’être libéré que lentement au cours du temps. Si les mousses d’isolation (polyuréthane) contenues dans les frigidaires et réfrigérateurs domestiques peuvent être récupérées afin de détruire les CFC qui y sont contenus (ce qui est actuellement le cas au sein de la société RECYDEL située en Région Liégeoise, voir ci-après), la récupération des mousses d’isolation installées dans les bâtiments n’est pas réalisée car cette opération serait trop complexe et coûteuse à mettre en œuvre. Dès lors, les émissions wallonnes de substances appauvrissant la couche d’ozone resteront dominées pour de nombreuses années par les émissions de CFC provenant de ces mousses.
Installations frigorifiques
La réduction très importante des émissions de CFC a été dans un premier temps liée à la mise en œuvre d’un l’Arrêté royal datant du 7 mars 1991 réglementant l’utilisation de certains composés chlorofluorocarbonés (CFC) dans les installations frigorifiques. Ensuite c’est le Protocole de Montréal et réglementation européenne qui ont interdit leur utilisation et leur mise sur le marché.
Il convient de signaler que la réglementation européenne interdit l’utilisation de HCFC dans l’ensemble des installations de réfrigération construites depuis le 1er janvier 2004, et que par ailleurs leur utilisation pour effectuer l’appoint de réfrigérant dans des installations existantes est interdite depuis le 1er janvier 2015.
Systèmes fixes de protection contre les incendies et extincteurs portables
Les émissions résiduelles provenant des installations et extincteurs contenant des halons proviennent des installations pour lesquelles l’utilisation de ces gaz reste autorisée (utilisations critiques) ainsi que des éventuelles autres installations qui n’auraient pas été démantelées.